
مس (II) کلرید ترکیب شیمیایی با فرمول شیمیایی CuCl2 است. مس (II) کلرید هنگام بی آبی قهوه ای روشن است. وقتی هیدراته شود سبز است. این یک ماده اکسید کننده ضعیف است. مس (II) کلرید شامل یک کلرید غیر آلی و یک مولکول مس است. کلرید کاپریک، پودر زرد قهوه ای، کاملاً محلول در H2O سرد یا الکل است. مس (II) کلرید کاتالیزور چندین واکنش سنتزی مواد آلی، از جمله تولید مونومر وینیل کلرید است.
مس II کلرید
مس II کلرید | خرید مس II کلرید | فروش مس II کلرید | قیمت مس II کلرید | خرید | فروش

این ماده ترکیب شیمیایی با فرمول شیمیایی CuCl۲ است. این ماده یک ماده جامد قهوه ای روشن است که به آرامی رطوبت را جذب کرده و یک هیدرات سبز به رنگ سبز آبی ایجاد می کند.
هر دو نوع بی آب و دی هیدرات به ترتیب به عنوان مواد معدنی بسیار کمیاب تولباخیت و اریو کالسیت به وجود می آیند.این ماده بی آب یک ساختار کادمیوم یدید را تحریف می کند. در این موتیف، مراکز مس به صورت هشت وجهی است.
روش تولید مس (II) کلرید
CuCl۲ وقتی اکسید مس (II)، با اسید کلریدریک، تحت درمان قرار می گیرد، تشکیل می شود.
HCl: CuO + 2HCI → CuCl۲ + H۲O
کلرید مس (II) ممکن است با گرم کردن مس اولیه با کلر سنتز شود:
Cu + Cl2 → CuCl2
متناوباً، ممکن است با تیمار کربنات مس با اسید کلریدریک و سپس تبلور تهیه شود:
CuCO۳ + ۲HCl → CuCl۲ + CO۲ + H۲O
در آماده سازی فوق، هیدرات نمک متبلور می شود، رسوب می کند و ممکن است با گرم شدن در خلا دهیدراته شود.
کاربرد های مس (II) کلرید
این ماده، برای تزریق، یک محلول استریل و غیرپیروژنیک است که برای استفاده به عنوان افزودنی در محلولهای تغذیه کامل پارانترال (TPN) استفاده می شود.
این ماده برای تولید سایر مواد شیمیایی، در رنگرزی، چاپ، در قارچ کش ها، به عنوان نگهدارنده چوب استفاده می شود.
این ماده کلرید غیر آلی مس است که در آن فلز در حالت اکسیداسیون ۲+ قرار دارد. این ماده به عنوان یک بازدارنده EC 5.3.3.5 (کلستنول دلتا ایزومراز) نقش دارد.
از این ماده به عنوان ماده ای مهم در رنگ آمیزی و چاپ پارچه استفاده می شود. به عنوان یک ماده تشکیل دهنده ایزومریزاسیون و کاتالیزورهای ترک خوردگی شناخته می شود. و به عنوان یک عامل گوگردزدایی و عطرزدایی در صنعت نفت کاربرد دارد. سایر کاربردهای مهم این ماده در آبکاری مس از آلومینیوم است. در حمام های رنگ آمیزی آهن و قلع، در رنگدانه ها برای سرامیک و عینک، به عنوان یک ثابت کننده و واکنش دهنده حساسیت زدایی در عکاسی نیز از این ماده استفاده می شود. در استخراج جیوه از سنگ معدن و در تولید چندین نمک مس، از این ماده استفاده می شود.
خصوصیات فیزیکی و شیمیایی مس (II) کلرید
این ماده، CuCl۲ یک نمک جامد بی آب و قهوه ای رنگ است که در آب محلول است و هنگام غلیظ شدن محلول آبی قهوه ای می دهد. با رقیق شدن، محلول رنگ خود را به سبز و سپس آبی تغییر می دهد.
فرم بی آب این ماده، بلورهای مونوکلینیک زرد تا قهوه ای را تشکیل می دهد. نمناک است. در معرض هوای مرطوب دی هیدرات ایجاد می کند. چگالی این ماده، ۳.۴۰ گرم در سانتی متر مکعب است. در حدود ۶۳۰ درجه سانتی گراد همراه با تجزیه شدن، ذوب می شود. محلول در آب، اتانول و استون است.
فرم دی هیدراته این ماده به صورت بلورهای orthhorhombic آبی مایل به سبز وجود دارد. چگالی آن g / cm۳۲.۵۱ است. در ۱۰۰ درجه سانتی گراد تجزیه می شود در آب و اتانول بسیار محلول است (حلالیت آن بیشتر از نمک بی آب در این حلال ها است). فرم دی هیدراته این ماده همچنین در استون محلول است ولی در اتر نامحلول است.
|
۶۲۰ °C(lit.)
|
Melting point
|
|
۹۹۳°C/760mmHg
|
Boiling point
|
|
۳.۳۸۶ g/mL at 25 °C(lit.)
|
Density
|
|
۲-۸°C
|
storage temp.
|
|
H۲O: soluble
|
solubility
|
|
powder
|
form
|
|
۳.۵ (۵۰g/l, H2O, 20℃)
|
PH
|
|
Stable. Reacts violently with potassium and sodium. Contact with acetylene may form explosive acetylides. Hygroscopic.
|
ability
|
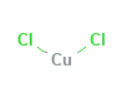 |
Structure |
 |
Chemical Safety |
| CuCl۲ or Cl۲Cu | Molecular Formula |
|
CUPRIC CHLORIDE Copper chloride Copper(II) chloride Copper dichloride ۷۴۴۷-۳۹-۴
|
Synonyms |
| ۱۳۴.۴۵ g/mol | Molecular Weight |
واکنش ها
هنگامی که این ماده بیش از ۳۰۰ درجه سانتیگراد گرم می شود، تا حدی به کلرید مس و کلر تجزیه می شود:
۲CuCl۲ → ۲CuCl + Cl
همچنین، وقتی با عوامل احیا کننده تحت درمان قرار می گیرد، به CuCl و مس اولیه کاهش می یابد.
با استفاده از فلورین، فلوراید مس (II)، CuF۲ تولید می کند. افزودن فروسیانید پتاسیم به محلول آبی CuCl۲ باعث رسوب فروسیانید کاپریک قهوه ای مایل به قرمز می شود. واکنش با سود سوزآور هیدروکسید کاپریک آبی ایجاد می کند:
CuCl۲ + ۲NaOH → Cu (OH) ۲ + ۲NaCl
سولفور مس سیاه(II)،CuS ، هنگامی حاصل می شود که سولفید هیدروژن از CuCl۲ محلول عبور داده شود.
کلرید مس (II)چندین مجتمع مس (II) با چندین نوع لیگاند در محلول های آبی تشکیل می دهد.
مس (II)کلرید دارای قدرت اکسید کننده یااحیا کننده ضعیفی است. اکثر ترکیبات این کلاس در آب کمی محلول یا نامحلول هستند. اگر محلول در آب باشد، محلول ها معمولاً نه به شدت اسیدی هستند و نه به شدت بازی هستند. این ترکیبات در برابر آب واکنش نشان نمی دهند.
نکاتی درمورد مس (II) کلرید
مس (II) کلرید با اسیدهای قوی نمک های مس یک ظرفیتی و گاز هیدروژن کلرید سمی را تشکیل می دهد. با پتاسیم، سدیم، سدیم هیپوبرومیت، نیترومتان، استیلن، ترکیبات حساس به ضربه و منفجر ایجاد می کند. مس (II) کلرید باید دور از رطوبت و فلزات قلیایی نگهداری شود. در صورت وجود رطوبت به فلزات حمله می کند. با هوای مرطوب واکنش داده و دی کلرات کلرید کاپریک را تشکیل می دهد. ممکن است به برخی از فلزات، رنگها و پوشش ها حمله کند. ممکن است بتواند مواد قابل احتراق را مشتعل کند.
منابع :
https://www.chemicalbook.com/ChemicalProductProperty_EN_CB1144723.htm
https://pubchem.ncbi.nlm.nih.gov/compound/Cupric-chloride



 شرکت اوج آزما پلاست در سال 1392 در ایران تاسیس گردید. هدف اصلی همکاران ما کوشش در جهت بالابردن سطح سلامت در جامعه جهانی است. شرکت اوج آزما پلاست در زمینه واردات و تولیدات تجهیزات و ملزومات آزمایشگاهی و بیمارستانی فعالیت داشته و از ابتدای شروع فعالیت همواره
شرکت اوج آزما پلاست در سال 1392 در ایران تاسیس گردید. هدف اصلی همکاران ما کوشش در جهت بالابردن سطح سلامت در جامعه جهانی است. شرکت اوج آزما پلاست در زمینه واردات و تولیدات تجهیزات و ملزومات آزمایشگاهی و بیمارستانی فعالیت داشته و از ابتدای شروع فعالیت همواره