
منیزیم سولفات نمکی غیر آلی (ترکیب شیمیایی) حاوی منیزیم، گوگرد و اکسیژن است که دارای فرمول MgSO4 است. این ماده به شدت رطوبت ساز است و اغلب به عنوان ماده معدنی اپسومیت سولفات هپتاهیدرات (MgSO4 • 7H2O) که معمولاً نمک اپسوم نامیده می شود، و مونوهیدرات، MgSO4 • H2O، به عنوان ماده معدنی کی سریت یافت می شود.منیزیم سولفات ماده معدنی طبیعی است که برای کنترل سطح پایین منیزیم در خون استفاده می شود. تزریق منیزیم سولفات همچنین برای نفریت حاد کودکان و جلوگیری از تشنج در اکلامپسی استفاده می شود.
منیزیم سولفات
منیزیم سولفات | خرید منیزیم سولفات | فروش منیزیم سولفات | قیمت منیزیم سولفات | خرید | فروش | قیمت | خرید | فروش منیزیم سولفات | قیمت | فروش | خرید

سولفاتهای منیزیم مواد معدنی رایج در محیط های زمین شناسی است. برخی از آنها نیز سازنده های مهم رسوبات نمک های پتاسیم-منیزیم (K-Mg) تبخیری هستند. تقریباً همه اشکال معدنی شناخته شده MgSO۴ هیدراته هستند. اپسومیت آنالوگ طبیعی “نمک اپسوم” است. مریدانیانیت، MgSO۴ · ۱۱H۲O ، در سطح دریاچه های یخ زده مشاهده شده است و تصور می شود که در مریخ نیز رخ دهد.این ماده بی آب از برخی از زباله های سوزاننده ذغال سنگ گزارش شده است.این ماده یک ترکیب شیمیایی نمکی با فرمول MgSO۴، متشکل از کاتیون های منیزیم و آنیون های سولفات SO۴۲−است.
این ماده جامد بلوری سفید است، در آب محلول است اما در اتانول حل نمی شود.این ماده معمولاً به صورت هیدراته MgSO۴ · nH۲O برای مقادیر مختلف n بین ۱ تا ۱۱ دیده می شود. متداول ترین فرم منیزیم سولفات هپتاهیدرات MgSO۴ · ۷H۲O است، که معروف به نمک اپسوم، که یک ماده شیمیایی خانگی با کاربردهای سنتی، از جمله نمک های حمام است.استفاده اصلی از این ماده در کشاورزی، برای اصلاح خاک های کمبود منیزیم (یک ماده مغذی ضروری گیاه) است. فرم مونوهیدرات این ماده برای این استفاده مطلوب است. در اواسط دهه ۱۹۷۰، تولید آن ۲.۳ میلیون تن در سال بود. فرم بی آب و چندین هیدراته این ماده در طبیعت به صورت مواد معدنی و نمک جز قابل توجه در آب برخی چشمه ها است.
هپتاهیدرات (نمک اپسوم)
هپتاهیدرات نام معمول خود را “نمک اپسوم” از یک چشمه شور تلخ در اپسوم در surrey انگلیس گرفته است، جایی که نمک از چشمه هایی تولید می شود که در آنجا گچ متخلخل North Downs با خاک رس غیر لورن لندن روبرو می شود.هپتا هیدرات به راحتی یک معادل آب از دست می دهد تا هگزاهیدرات تشکیل شود.نمکهای Epsom معمولاً در نمکهای حمام، لایه بردارها، شل کننده های عضلات و مسکن ها استفاده می شوند. با این حال، اینها با نمکهای Epsom که برای باغبانی استفاده می شوند متفاوت است، زیرا حاوی رایحه و عطرهای مناسب گیاهان نیستند.
مونوهیدرات
مونوهیدرات را می توان با حرارت دادن هگزاهیدرات تا حدود ۱۵۰ درجه سانتی گراد تهیه کرد. گرم شدن بیشتر تا حدود ۳۰۰-۳۲۰ درجه سانتی گراد، این ماده بی آب می دهد.
Undecahydrate
این فرم از این ماده فقط در فشار جو کمتر از ۲ درجه سانتی گراد پایدار است. بالاتر از آن دما، به مخلوط هپتاهیدرات جامد و محلول اشباع تبدیل می شود.این ماده (MgS0۴) یک کریستال بی رنگ با طعم شور و تلخ است. این ماده در گلیسرول محلول است و در مواد نسوز، فرآیندهای نساجی، سرامیک، مواد آرایشی و کودها استفاده می شود.
تولید منیزیم سولفات
این ماده معمولاً مستقیماً از بسترهای خشک دریاچه و سایر منابع طبیعی بدست می آید. این ماده هیدراته در طبیعت به عنوان مواد معدنی کیزریت و اپسومیت وجود دارد. نمک در مقیاس وسیع از این مواد معدنی و سایر مواد معدنی طبیعی استخراج می شود. همچنین می تواند با واکنش منیزیت (منیزیم کربنات MgCo۳)یا منیزیا (oxide, MgO) با سولفوریک اسید تهیه شود.
روش ممکن دیگر تولید منیزیم سولفات، تصفیه پساب های صنعتی آب دریا یا منیزیم است تا هیدروکسید منیزیم رسوب کرده و رسوب را با اسید سولفوریک واکنش دهد.
این نمک در اثر آزمایش اسید سولفوریک روی اکسید منیزیم، هیدروکسید یا کربنات و به دنبال آن تبخیر و تبلور در آزمایشگاه تهیه می شود:
MgO + H۲SO۴ → MgSO۴ + H۲O
Mg (OH)۲ + H۲SO۴ → MgSO۴ + ۲H۲O
MgCO۳ + H۲SO۴ → MgSO۴ + CO۲ + H۲O
تبلور در دمای بین ۱.۸ و ۴۸ درجه سانتی گراد باعث تولید فرم هپتاهیدرات، MgSO۴ • ۷H۲O می شود. در زیر ۱.۸ درجه سانتی گراد، یک دودکاهیدرات، MgSO4 • ۱۲H2O متبلور می شود. در بالای ۴۸ درجه سانتی گراد، کریستال های هیدرات پایین ایجاد می شوند. نمک بی آب با حرارت دادن هپتاهیدرات در حدود ۵۰۰ درجه سانتی گراد در یک درام چرخشی بدست می آید. منیزیم سولفات همچنین درحضور اسید سولفوریک بیش از ۱۵۰ درجه سانتیگراد کم آب شود.
کاربرد های منیزیم سولفات
پزشکی
استفاده اصلی خارجی فرمولاسیون منیزیم سولفات به عنوان نمک های حمام است، به ویژه برای حمام پا برای تسکین درد پا. ادعا شده است که چنین حمامی باعث تسکین و تسریع در بهبودی از درد عضلانی، درد و آسیب می شود. اما این ادعاها از نظر علمی تأیید نشده اند. فواید اصلی نمک منیزیم سولفات مواد آرایشی است. منیزیم سولفات از چروک شدن موقتی پوست ناشی از غوطه وری طولانی مدت در آب ساده جلوگیری می کند. این ماده همچنین جز معمول محلول مورد استفاده در مخازن جداسازی است.
در انگلستان ادعا می شود دارویی حاوی منیزیم سولفات و فنل، به نام “drawing paste” برای جوش های کوچک یا عفونت های موضعی مفید است.منیزیم سولفات ممکن است از طریق دهان، تنفس یا راه های داخل وریدی تجویز شود. موارد استفاده داخلی شامل درمان جایگزینی برای کمبود منیزیم، درمان آریتمی حاد و شدید، به عنوان یک گشاد کننده برونش در درمان آسم، و پیشگیری از اکلامپسی است.
کشاورزی
در کشاورزی از منیزیم سولفات برای افزایش میزان منیزیم یا گوگرد در خاک استفاده می شود. این ماده معمولاً روی گیاهان گلدانی یا محصولات تشنه منیزیم مانند سیب زمینی، گوجه فرنگی، هویج، فلفل، لیمو و گل رز استفاده می شود. مزیت سولفات نسبت به سایر اصلاحات خاک منیزیم (مانند آهک دولومیتی) حلالیت زیادی دارد که گزینه تغذیه محلول پاشی را نیز امکان پذیر می کند. محلول های منیزیم سولفات نیز در مقایسه با نمک های قلیایی منیزیم که در سنگ آهک یافت می شود، تقریباً PH خنثی دارند. بنابراین، استفاده از منیزیم سولفات به عنوان منبع منیزیم برای خاک، pH خاک را به میزان قابل توجهی تغییر نمی دهد.
منیزیم سولفات در طول تاریخ به عنوان درمانی برای مسمومیت با سرب قبل از توسعه کلات درمانی مورد استفاده قرار می گرفت ، زیرا امید بود هر سرب خورده شده توسط منیزیم سولفات رسوب کرده و متعاقباً از دستگاه گوارش پاکسازی شود. این برنامه به ویژه در اوایل و اواسط قرن بیستم مورد استفاده گسترده دامپزشکان قرار گرفت. نمک اپسوم قبلاً در بسیاری از مزارع برای مصارف کشاورزی در دسترس بود و اغلب در معالجه حیوانات مزرعه ای که سهوا سرب را می خورند تجویز می شد.
صنایع غذایی
از منیزیم سولفات به عنوان نمک در تهیه آبجو استفاده می شود. همچنین ممکن است به عنوان یک ماده منعقد کننده برای ساخت توفو استفاده شود.
علم شیمی
منیزیم سولفات بی آب به دلیل تمایل به آب و سازگاری با اکثر ترکیبات آلی معمولاً به عنوان ماده خشک کننده در سنتز آلی استفاده می شود. در حین کار، یک فاز آلی با منیزیم سولفات بی آب تیمار می شود. سپس ماده جامد هیدراته شده با فیلتراسیون، تصفیه یا تقطیر (در صورت کم بودن نقطه جوش) از بین می رود. نمک های سولفات معدنی دیگر مانند سولفات سدیم و سولفات کلسیم نیز ممکن است به همین ترتیب استفاده شوند.
ساخت و ساز
از منیزیم سولفات برای تهیه سیمان های خاص توسط واکنش بین اکسید منیزیم و محلول منیزیم سولفات استفاده می شود که توانایی اتصال و مقاومت بیشتری نسبت به سیمان پرتلند دارند. این سیمان عمدتا در تولید پنل های عایق سبک استفاده می شود. ضعف در مقاومت در برابر آب استفاده از آن را محدود می کند.
آکواریوم
منیزیم سولفات هپتاهیدرات همچنین برای حفظ غلظت منیزیم در آکواریوم های دریایی که حاوی مقادیر زیادی از مرجان های سنگی هستند، استفاده می شود، زیرا در روند کلسیفیکاسیون آنها به آرامی تخلیه می شود. در یک آکواریوم دریایی با کمبود منیزیم ، کنترل غلظت کلسیم و قلیایی بسیار دشوار است زیرا منیزیم کافی برای تثبیت این یونها در آب شور و جلوگیری از رسوب خود به خود به کربنات کلسیم وجود ندارد.
خصوصیات فیزیکی و شیمیایی منیزیم سولفات
منیزیم سولفات به طور گسترده در طبیعت به عنوان یک نمک مضاعف یا به عنوان یک هیدرات، بلورهای بی رنگ، بسیار محلول در آب، محلول در گلیسرول، به میزان کم محلول در الکل یافت می شود.
|
۱۱۲۴ °C
|
Melting point
|
|
۱.۰۷ g/mL at 20 °C
|
Density
|
|
<0.01 (vs air)
|
Vapor density
|
|
<0.1 mm Hg ( 20 °C)
|
Vapor pressure
|
|
Store at room temperature.
|
Storage temp
|
|
H۲O: 1 M at ۲۰ °C, clear, colorless
|
Solubility
|
|
powder (very fine)
|
Form
|
|
slightly gray
|
Color
|
|
Soluble in water. Slightly soluble in alcohol, glycerol. Insoluble in acetone.
|
Water Solubility
|
|
۷.۹ (۵۰g/l, H2O, 25℃)
|
PH
|
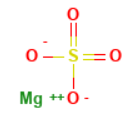 |
Structure |
 |
Chemical Safety |
| MgSO۴ or MgO۴S | Molecular Formula |
|
MAGNESIUM SULFATE ۷۴۸۷-۸۸-۹ Magnesium sulphate Magnesium sulfate anhydrous Sulfuric acid magnesium salt (1:1) |
Synonyms |
| ۱۲۰.۳۷ g/mol | Molecular Weight |
منابع :
https://pubchem.ncbi.nlm.nih.gov/compound/Magnesium-sulfate
https://go.drugbank.com/drugs/DB00653
https://www.chemicalbook.com/ChemicalProductProperty_EN_CB9122608.htm

 شرکت اوج آزما پلاست در سال 1392 در ایران تاسیس گردید. هدف اصلی همکاران ما کوشش در جهت بالابردن سطح سلامت در جامعه جهانی است. شرکت اوج آزما پلاست در زمینه واردات و تولیدات تجهیزات و ملزومات آزمایشگاهی و بیمارستانی فعالیت داشته و از ابتدای شروع فعالیت همواره
شرکت اوج آزما پلاست در سال 1392 در ایران تاسیس گردید. هدف اصلی همکاران ما کوشش در جهت بالابردن سطح سلامت در جامعه جهانی است. شرکت اوج آزما پلاست در زمینه واردات و تولیدات تجهیزات و ملزومات آزمایشگاهی و بیمارستانی فعالیت داشته و از ابتدای شروع فعالیت همواره