
هیدروکسید کبالت یک منبع کبالت کریستالی و محلول در آب برای استفاده های سازگار با محیط های با pH قلیایی است. هیدروکسید کبالت (II) بیشتر به عنوان ماده خشک کننده برای رنگ ها، لاک ها و جوهرها، در تهیه سایر ترکیبات کبالت، به عنوان کاتالیزور و در تولید الکترودهای باتری استفاده می شود.
هیدروکسید کبالت
هیدروکسید کبالت | خرید هیدروکسید کبالت | فروش هیدروکسید کبالت | قیمت هیدروکسید کبالت| خرید | فروش | خرید

این ماده یک ترکیب غیر آلی با فرمول Co(OH)۲ است که از کاتیون های کبالت دو ظرفیتی Co۲ + و آنیون های هیدروکسید HO− تشکیل شده است. این ترکیب خالص که غالباً به آن “فرم بتا” (β-Co (OH)۲) گفته می شود، یک جامد صورتی نا محلول در آب است.
این نام همچنین به یک ترکیب مرتبط اطلاق می شود، که اغلب به شکل “آلفا” یا “آبی” (α-Co (OH) 2) شناخته می شود، که آنیون های دیگری را در ساختار مولکولی خود ترکیب می کند. این ترکیب آبی نسبتاً ناپایدار است.فرم بتا را می توان به صورت پلاکت با هندسه جزئی شش ضلعی، عرض ۱۰۰-۳۰۰ نانومتر و ضخامت ۵-۱۰ نانومتر بدست آورد.
فرم آلفا (α-Co (OH)۲) پلی مورفی از شکل خالص (β) نیست، بلکه یک ترکیب پیچیده تر است که در آن لایه های هیدروکسید-کبالت-هیدروکسید دارای رزیدوهای با بار مثبت است و با لایه های آنیون های دیگر مانند نیترات، کربنات، کلرید و غیره (ساختار هیدروتالاسیت) جایگزین شده اند. معمولاً هنگامی که بازی مانند هیدروکسید سدیم به محلول نمک کبالت (II) اضافه می شود، رسوب آبی بدست می آید. رسوب به آرامی به فرم بتا تبدیل می شود.
به طور کلی افزودن هیدروکسیدهای فلز قلیایی به محلول های نمک های کبالت (II) بسته به شرایط باعث رسوب این ماده به صورت آبی یا صورتی می شود.هیدروکسید کبالت(II) آمفوتریک است و در مواد قلیایی حل می شود و محلول های آبی یون های ۲[[Co (OH)۴] را تشکیل می دهد.
در حضور مواد قلیایی، سوسپانسیون Co(OH)۸ توسط هوا به CoO(OH) قهوه ای اکسید می شود، این اکسیداسیون به سرعت توسط اکسیدان هایی مانند هیپوکلریت، آب برم یا پراکسید هیدروژن ایجاد می شود.
روش تولید این ماده
این ماده هنگامی که هیدروکسید فلز قلیایی به محلول آبی + نمک Co2 اضافه می شود، به صورت جامد رسوب می کند. مثلا:
Co۲ + + ۲ NaOH → Co(OH)۲ + ۲Na +
این ترکیب را می توان با واکنش نیترات کبالت (II) در آب با محلول تری اتیل آمین N (C۲H۵)۳ هم به عنوان باز و هم به عنوان عامل کمپلکس تهیه کرد. همچنین می تواند با الکترولیز محلول نیترات کبالت با کاتد پلاتین تهیه شود.
رسوب این ماده با افزودن هیدروکسید سدیم (NaOH) به محلول حاوی یونهای کبالت تشکیل می شود. این ماده (Co (OH)۲) به صورت یک جامد آبی تیره از محلول رسوب می کند. از افزودن هیدروکسید سدیم به عنوان آزمایشی برای یونهای مثبت فلز در محلول استفاده می شود.
CoCl۲ + ۲NaOH → Co(OH)۲ + ۲NaCl
Co (NO۳)۲ + ۲NaOH → Co (OH)۲ + ۲NaNO۳
کاربرد های این ماده
این ماده به عنوان خشک کن برای رنگ و لاک استفاده می شود و به جوهرهای چاپ لیتوگرافی اضافه می شود تا خواص خشک کنندگی آنها را افزایش دهد. سایر کاربردهای این ماده در تهیه نمک های کبالت است. به عنوان یک کاتالیزور و در الکترودهای باتری ذخیره سازی نیز از کبالت هیدروکسید استفاده می شود.
نانولوله ها
این ماده را می توان به صورت لوله های نانو بدست آورد که ممکن است مورد توجه فناوری نانو و علوم مواد باشد.
خصوصیات فیزیکی و شیمیایی این ماده
این ماده صورتی با چگالی ۳.۵۹۷ دارای ساختار بروسیت (Mg(OH)۲) است که در آن اتم های کبالت توسط شش هیدروکسید احاطه شده اند. شکل آبی بیشتر بی نظم است، اما ساختار آن به طور قطعی شناخته نشده است.
این ماده به دو شکل وجود دارد، یک پودر گل رز قرمز (پایدارتر) و یک پودر سبز مایل به آبی که نسبت به فرم قرمز نا پایدارتر است.کبالت هیدروکسید به صورت بلورهای rhombohedral وجود دارد. چگالی کبالت هیدروکسیدg / cm۳۳.۵۹۷ است. کبالت هیدروکسید در اثر حرارت تجزیه می شود. عملا غیر قابل حل در آب است ولی در اسیدها و آمونیاک محلول است. کبالت هیدروکسید در قلیاهای رقیق نامحلول است. این ماده در ۱۶۸ درجه سانتیگراد تحت خلا به اکسید کبالت (II) تجزیه می شود و توسط هوا اکسید می شود. محصول تجزیه حرارتی در هوای بالاتر از ۳۰۰ درجه سانتیگراد Co۳O۴ است.مانند هیدروکسید آهن (II)، این ماده نیز یک هیدروکسید بازی است و با اسیدها واکنش داده و نمک های کبالت (II) را تشکیل می دهد.
|
°Cd ec.)
|
Melting point
|
|
۳.۵۹۷ g/mL at 25 °C(lit.)
|
Density
|
|
۳.۵۹۷
|
Specific Gravity
|
|
Pink to purple
|
color
|
|
Soluble in acids and ammonia. Very slightly soluble in water. Insoluble in dilute alkalis.
|
Water Solubility
|
| Air Sensitive |
Sensitive
|
|
Stability
|
Stability
|
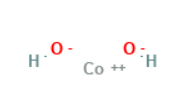 |
Structure |
| CoH۲O۲ | Molecular Formula |
|
COBALT HYDROXIDE ۱۲۶۷۲-۵۱-۴ cobalt(2+);dihydroxide Cobalt(II) hydroxide, 95%, pure Cobalthydroxide |
Synonyms |
| ۹۲.۹۴۸ g/mol | Molecular Weight |
نکاتی درمورد این ماده
تجزیه حرارتی این ماده به اکسید کبالت(CoO)، در دمای ۱۶۸ درجه سانتی گراد در خلا رخ می دهد. این ماده توسط هوا و سایر عوامل اکسید کننده اکسید می شود و این ماده را تشکیل می دهد. واکنش با اسیدهای معدنی نمک های ۲+ Co مربوطه را تولید می کند.
منابع :
https://www.chemicalbook.com/ChemicalProductProperty_EN_CB0716301.htm
https://pubchem.ncbi.nlm.nih.gov/compound/Cobalt-hydroxide
 شرکت اوج آزما پلاست در سال 1392 در ایران تاسیس گردید. هدف اصلی همکاران ما کوشش در جهت بالابردن سطح سلامت در جامعه جهانی است. شرکت اوج آزما پلاست در زمینه واردات و تولیدات تجهیزات و ملزومات آزمایشگاهی و بیمارستانی فعالیت داشته و از ابتدای شروع فعالیت همواره
شرکت اوج آزما پلاست در سال 1392 در ایران تاسیس گردید. هدف اصلی همکاران ما کوشش در جهت بالابردن سطح سلامت در جامعه جهانی است. شرکت اوج آزما پلاست در زمینه واردات و تولیدات تجهیزات و ملزومات آزمایشگاهی و بیمارستانی فعالیت داشته و از ابتدای شروع فعالیت همواره