
کلرید جیوه(II) با فرمول شیمیایی (HgCl2) ترکیبی بسیار سمی است که در دمای معمولی کمی فرار می کند و به میزان قابل توجهی در 100 درجه سانتی گراد فرار می کند و برای غشاهای مخاطی خورنده است و به عنوان ماده ضد عفونی کننده استفاده می شود. کلرید مرکوریک برای ضد عفونی زخم ها توسط پزشکان عرب در قرون وسطی مورد استفاده قرار گرفت اما از آن زمان پزشکی مدرن آن را برای استفاده ناامن می داند.
کلرید جیوه II
کلرید جیوه II | خرید کلرید جیوه II | فروش کلرید جیوه II | قیمت کلرید جیوه II خرید | خرید | فروش | فروش | قیمت | قیمت
کلرید جیوه (II) یا کلرید جیوه، ترکیب شیمیایی شامل دو جز جیوه و کلر با فرمول HgCl۲ است. این ماده جامد بلوری سفید رنگ است. کلرید جیوه II یک معرف آزمایشگاهی و یک ترکیب مولکولی است که برای انسان بسیار سمی است.
کلرید جیوه از مولکولهای سه اتمی خطی تشکیل شده است و در آن یک اتم جیوه به دو کلر پیوند می خورد. کلرید جیوه II محلول در آب است. هنگامی که در طیف گسترده ای از کاربرد ها از جمله حفظ چوب و نمونه های تشریحی، مومیایی کردن و ضد عفونی کردن، به عنوان یک تقویت کننده در عکاسی مورد استفاده قرار گرفت،با توجه به سمیتی که در افراد ایجاد می کرد، موادی که سمیت آن ها کمتر از کلرید جیوه است، جایگزین شدند.
روش تولید کلرید جیوه II
کلرید جیوه نمک نیست بلکه یک مولکول سه اتمی خطی است. در کریستال، هر اتم جیوه به دو لیگاند نزدیک کلرید با فاصله ۲.۳۸ Å پیوند خورده است. چهار کلرید دیگر با فاصله ۳.۳۸ فاصله بیشتری دارند.
کلرید جیوه از طریق اثر کلر روی جیوه یا کلرید جیوه (I) بدست می آید. همچنین می تواند با افزودن اسید کلریدریک به محلول گرم و غلیظ ترکیبات جیوه (I) مانند نیترات تولید شود:
Hg۲ (NO۳) ۲ + ۴ HCl → ۲ HgCl۲ + ۲ H۲O + 2 NO۲
گرمایش مخلوط سولفات جیوه جامد (II) و کلرید سدیم همچنین باعث ایجاد HgCl۲ فرار می شود که با تصعید از هم جدا می شود.
کاربرد های کلرید جیوهII
کاربرد اصلی کلرید جیوه به عنوان یک کاتالیزور برای تبدیل استیلن به وینیل کلراید است.
C۲H۲ + HCl → CH۲ = CHCl
برای این کاربرد، کلرید جیوه در غلظت های حدود ۵ درصد وزنی روی کربن تهیه می شود. این فناوری با ترک خوردگی حرارتی ۱،۲-دی کلرو اتان تحت الشعاع قرار گرفته است. از دیگر کاربردهای قابل توجه کلرید جیوه می توان به استفاده از آن به عنوان دپولایزر در باتری ها و به عنوان معرف در سنتز آلی و شیمی تجزیه اشاره کرد. این ماده در کشت بافت گیاهی برای عقیم سازی سطحی ریزنمونه هایی مانند گره های برگ و ساقه مورد استفاده قرار می گیرد.
از کلرید مرکوریک (کلرید جیوه II) گاهی اوقات برای تشکیل آمالگام با فلزات مانند آلومینیوم استفاده می شود. پس از تیمار با محلول آبی کلرید جیوه، نوارهای آلومینیوم به سرعت توسط یک لایه نازک از آمالگام پوشانده می شوند. به طور معمول، آلومینیوم توسط یک لایه نازک اکسید محافظت می شود، بنابراین آن را بی اثر می کند. آلومینیوم پس از ادغام، می تواند واکنش های مختلفی را متحمل شود. به عنوان مثال، با حذف لایه اکسید، آلومینیوم در معرض بلافاصله با تولید آب Al (OH) ۳ و گاز هیدروژن واکنش نشان می دهد. هالوکربن ها در واکنش باربیر با آلومینیوم آمیخته شده واکنش می دهند. این ترکیبات آلکیل آلومینیوم نوکلئوفیلیک هستند و می توانند به روشی مشابه معرف گریگنارد استفاده شوند. آلومینیوم آمیخته نیز به عنوان یک عامل احیا کننده در سنتز آلی استفاده می شود. روی نیز معمولاً با استفاده از کلرید جیوه ترکیب می شود.
از کلرید مرکوریک برای از بین بردن گروههای دیتیان متصل به یک کربونیل در واکنش umpolung استفاده می شود. این واکنش از میل بالای Hg۲ برای لیگاندهای گوگرد آنیونی بهره می برد.کلرید مرکوریک (کلرید جیوه II) ممکن است به عنوان یک عامل تثبیت کننده برای مواد شیمیایی و نمونه های تحلیلی استفاده شود.از کلرید جیوه (I) در الکترودهای کالومل استفاده می شود. همچنین در نقاشی سرامیک به عنوان قارچ کش در صنایع آتش بازی برای تولید نور سبز تیره و، در کشاورزی برای کنترل کرم ریشه نیز از این ماده استفاده می شود.
کلرید جیوه (II) به عنوان یک تقویت کننده عکاسی برای تولید تصاویر مثبت در سال ۱۸۰۰ استفاده شده است.برای حفظ نمونه های انسان شناسی و بیولوژیکی در اواخر قرن نوزدهم و اوایل قرن ۲۰ ، اجسام در آن فرو رفته یا با “محلول جیوه” رنگ آمیزی شدند. این کار برای جلوگیری از تخریب نمونه ها توسط پروانه ها، کنه ها و کپک صورت گرفت. اشیا موجود در کشوها با پراکنده کردن کلرید جیوه متبلور بر روی آنها محافظت می شود. این ماده کاربرد کمی در دباغی دارد، و چوب با کیانیزاسیون (خیساندن در کلرید جیوه) حفظ شده است.
از کلرید مرکوریک برای ضد عفونی زخم ها توسط پزشکان عرب در قرون وسطی استفاده می شد. استفاده از این دارو تا قرن بیستم توسط پزشکان عرب ادامه داشت، تا اینکه پزشکی مدرن آن را برای استفاده ناامن دانست.قبل از ظهور آنتی بیوتیک ها سفلیس اغلب با کلرید جیوه تحت درمان قرار گرفت. استنشاق، بلع، تزریق و به صورت موضعی اعمال شد. هم درمان جیوه با کلرید جیوه و هم مسمومیت در طول دوره درمان آنقدر رایج بود که علائم دومی اغلب با علائم سفلیس اشتباه گرفته می شد.
خصوصیات فیزیکی و شیمیایی کلرید جیوه II
کلرید جیوه II، HgC1۲، بلورهای سفید است که در آب و الکل محلول هستند و در دمای ۲۷۶ درجه سانتی گراد ذوب می شوند و در دمای ۳۰۲ درجه سانتی گراد می جوشند.
|
۲۷۷ °C(lit.)
|
Melting point
|
|
۳۰۲ °C
|
Boiling point
|
|
۵.۴۴
|
Density
|
|
۱.۳ mm Hg ( 236 °C)
|
Vapor pressure
|
|
۳۰۲°C
|
Flash point
|
|
Store at RT.
|
Storage temp
|
|
H۲O: soluble
|
Solubility
|
|
powder
|
Form
|
|
Stability Stable, but moisture sensitive and light sensitive – decomposes in sunlight. Incompatible with strong acids, ammonia, carbonates, metallic salts, alkalies, phosphites, phosphates, sulfites, sulfates, arsenic, antimony, bromides.
|
Stability
|
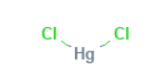 |
Structure |
 |
Chemical Safety |
| HgCl۲ or Cl۲Hg | Molecular Formula |
|
MERCURIC CHLORIDE Mercury(II) chloride Dichloromercury Sublimate Mercury bichloride |
Synonyms |
| ۲۷۱.۵ g/mol | Molecular Weight |
نکاتی درمورد کلرید جیوه II
کلرید جیوه به شدت سمی طبقه بندی می شود. تمام اشکال جیوه در صورت جذب سمی است. کلرید جیوه در اثر نور خورشید تجزیه می شود. ناسازگار با سولفیت های مورفات، فپوفسفیت ها، فسفات ها، سولفیدها، آلبومین، ژلاتین، مواد قلیایی، نمک های آلکالوئید، آمونیاک، آب آهک، آنتیموان، آرسنیک، برومیدها ، بوراکس، کربنات ها، آهن، مس، سرب و نمک های نقره است.
کلرید جیوه چه به صورت حاد و چه به صورت موضعی بسیار سمی است. سمیت آن نه تنها به دلیل محتوای جیوه بلکه به دلیل خاصیت خورنده آن است که می تواند باعث آسیب جدی داخلی از جمله زخم معده، دهان و گلو و آسیب خوردگی روده شود. کلرید جیوه همچنین تمایل به تجمع در کلیه ها دارد و باعث آسیب شدید خورنده می شود که می تواند منجر به نارسایی حاد کلیه شود. با این حال ، کلرید جیوه ، مانند همه نمک های جیوه غیر آلی، به سادگی از جیوه آلی از سد مغز خون عبور نمی کند.
عوارض جانبی شایع مسمومیت حاد کلرید جیوه شامل احساس سوزش در دهان و گلو، درد معده، ناراحتی شکمی، بی حالی، استفراغ خونی، برونشیت خورنده، تحریک شدید دستگاه گوارش و نارسایی کلیه است. قرار گرفتن در معرض مزمن می تواند منجر به علائمی شود که بیشتر با مسمومیت با جیوه مشاهده می شود، مانند بی خوابی، تأخیر در رفلکس، ترشح بزاق زیاد، خونریزی لثه، خستگی، لرزش و مشکلات دندانی.
منابع :
https://pubchem.ncbi.nlm.nih.gov/compound/Mercuric-chloride
https://www.chemicalbook.com/ChemicalProductProperty_EN_CB1134977.htm
https://www.chemeurope.com/en/encyclopedia/Mercury%28II%29_chloride.html
 شرکت اوج آزما پلاست در سال 1392 در ایران تاسیس گردید. هدف اصلی همکاران ما کوشش در جهت بالابردن سطح سلامت در جامعه جهانی است. شرکت اوج آزما پلاست در زمینه واردات و تولیدات تجهیزات و ملزومات آزمایشگاهی و بیمارستانی فعالیت داشته و از ابتدای شروع فعالیت همواره
شرکت اوج آزما پلاست در سال 1392 در ایران تاسیس گردید. هدف اصلی همکاران ما کوشش در جهت بالابردن سطح سلامت در جامعه جهانی است. شرکت اوج آزما پلاست در زمینه واردات و تولیدات تجهیزات و ملزومات آزمایشگاهی و بیمارستانی فعالیت داشته و از ابتدای شروع فعالیت همواره