
کلرید نیکل یک ترکیب معدنی بلوری و به رنگ سبز یا زرد است که با گرم شدن گازهای سمی تولید می کند. نیکل کلرید در آبکاری، کاتالیزورهای نیکل و جذب آمونیاک در ماسک های جاذب گاز صنعتی استفاده می شود. قرار گرفتن در معرض این ماده می تواند باعث درماتیت شدید، حساسیت های پوستی و آسم مانند شود و ریه ها، کلیه ها، دستگاه گوارش و سیستم عصبی را تحت تأثیر قرار دهد. کلرید نیکل یک ماده سرطان زا شناخته شده است و با افزایش خطر ابتلا به سرطان های ریه و بینی در ارتباط است. نیکل کلراید بی آب با سوزاندن نیکل در گاز کلر تهیه می شود.
کلرید نیکل شش آبه
کلرید نیکل شش آبه | خرید کلرید نیکل شش آبه | فروش کلرید نیکل شش آبه | قیمت کلرید نیکل شش آبه | خرید | فروش
نیکل (II) کلرید (یا کلرید نیکل)، ترکیب شیمیایی با فرمول NiCl۲ است. نیکل (II) کلرید نمک بی آب زرد است، اما فرم هیدراته آن NiCl۲ · ۶H۲O سبز است. نیکل (II) کلرید، به اشکال مختلف، مهمترین منبع نیکل برای سنتز شیمیایی است. نیکل کلریدها نرم کننده بوده و رطوبت هوا را جذب کرده و محلول ایجاد می کنند. مطالعات نشان داده شده است که نمک های نیکل در اثر قرار گرفتن در معرض استنشاق طولانی مدت، برای ریه و مجاری بینی سرطان زا هستند. نیکل کلراید (NiCl۲) برای آبکاری نیکل بر روی سطح سایر فلزات و به عنوان یک واکنش شیمیایی در آزمایشگاه ها استفاده می شود.
هنگامی که گاز آمونیاک از روی کلرید نیکل بی آب عبور داده می شود، محصول واکنش آمونیاک و، کلرید نیکل هگزامین، NiCl2 • ۶NH3 است. آمونیاک همچنین می تواند با حل شدن نیکل کلرید هگزاهیدرات در محلول آبی آمونیاک در محلول تهیه شود.نیکل کلراید با کلریدهای فلز قلیایی یا کلرید آمونیوم نمک های دوتایی ایجاد می کند.
گرم شدن محلول کلرید نیکل و هیدروکسید سدیم در غلظت های متوسط ممکن است تا حدی نمک با ترکیب نامشخص رسوب کند. ترکیب متوسط این نمک NiCl۲ • ۳Ni (OH) ۲ است. ترکیب نمک ممکن است بسته به شرایط واکنش متفاوت باشد.وقتی سولفید هیدروژن از یک محلول بافر کلرید نیکل عبور می کند، سولفید نیکل، رسوب می کند.
یک محلول الکلی از کلرید نیکل، هنگامی که با یک محلول از اسید دیتیوبنزوئیک تیمار شود، نیکل آبی (II) دیتیوبنزوات، تشکیل می شود:
NiCl۲ + ۲C۶H۵CSSH → Ni (C6H۵CSS) ۲ + ۲HCl
این محصول به راحتی اکسید می شود و به یک کمپلکس نیکل (IV) بنفش تبدیل می شود.
روش تولید کلرید نیکل(II)
بزرگترین تولید مقیاس کلرید نیکل شامل استخراج اسید کلریدریک نیکل matte و باقیمانده حاصل از پخت تصفیه سنگ معادن حاوی نیکل است.نیکل کلراید معمولاً در آزمایشگاه تهیه نمی شود زیرا ارزان است و ماندگاری بالایی دارد. حرارت دادن کلرید نیکل ۶ آبه در محدوده ۶۶-۱۳۳ درجه سانتی گراد باعث تولید کلرید نیکل دی هیدرات NiCl۲ · ۲H۲O می شود. هیدراتها با گرم شدن در تیونیل کلرید یا با گرم شدن در زیر جریان گاز HCl به شکل بی آب تبدیل می شوند. گرم کردن هیدرات ها نمی تواند به راحتی تأمین کننده دی کلرید بی آب باشد. دهیدراته شدن با تغییر رنگ از سبز به زرد همراه است.
نیکل کلراید بی آب ممکن است با گرم کردن فرم های هیدراته شده NiCl۲ تا دمای حدود ۲۰۰ درجه سانتی گراد تا حدود ۲۴۰ درجه سانتی گراد بدست آید. گرمایش NiCl۲ بالاتر از حدود ۲۴۰ درجه سانتی گراد، NiCl۲ تولید می کند که واکنش کمتری در آماده سازی کاتالیزور دارد و استفاده از آن ترجیح داده نمی شود.
برخی دیگر از روش های آماده سازی کلرید نیکل شامل این موارد است:
(۱) عملکرد استیل کلرید بر روی استات نیکل در یک حلال غیر آبی مانند بنزن:
(CH۳COO) 2Ni + 2CH۳COCl → NiCl۲ + ۲CH۳COOCOCH۳
(۲) عملکرد تیونیل کلرید بر روی کلرید نیکل هگزاهیدرات:
NiCl۲ • ۶H۲O + 6SOCl۲ → NiCl۲ + ۱۲HCl + 6SO۲
(۳) گرمایش نیکل کلرید هگزاهیدرات یا کلرید نیکل آمونیاک:
NiCl۲ • ۶H۲O → NiCl۲ + ۶H۲O
NiCl۲ • ۶NH۳ → NiCl۲ + ۶NH۳
هگزاهیدرات یا با اثر اسید کلریدریک رقیق گرم روی پودر نیکل یا با حل شدن اکسید نیکل در اسید کلریدریک رقیق و به دنبال آن تبلور تهیه می شود.
کاربرد های کلرید نیکل(II)
نیکل دی کلرید ترکیبی از نیکل و کلرید است که در آن نسبت نیکل (در حالت اکسیداسیون ۲+) به کلرید ۱: ۲ است. این ماده به عنوان یک مسدود کننده کانال کلسیم و یک هاپتن نقش دارداز کلرید نیکل بیشتر برای آبکاری نیکل استفاده می شود، که برای تهیه نمک های مختلف نیکل و کاتالیزورهای نیکل استفاده می شود. در هنگام آبکاری، باعث انحلال فلز آند نیکل می شود، در حالی که برای افزایش سطح الکترولیت محلول عمل می کند. نیکل کلراید می تواند به عنوان کاتالیزور برای سنتز آلی (به عنوان مثال پیرازولوفتالازینیل اسپیروکسیندول ها)، برای سنتز نانوذرات نیکل به عنوان یک احیا کننده، و برای آماده سازی ترکیبات کووردینات نیکل، و همچنین در ماسک های گاز صنعتی برای محافظت در برابر آمونیاک استفاده شود. همچنین می تواند به عنوان منبع یون نیکل برای کشت سلول و مطالعات سم شناسی مورد استفاده قرار گیرد.
خصوصیات فیزیکی و شیمیایی کلرید نیکل
نیکل کلراید ماده جامدی با رنگ قهوه ای یا سبز است. هگزاهیدرات آن یک کریستال منوکلینیکی سبز است. به راحتی در آب، اتانول و آمونیاک حل می شود. با گرم شدن در هیدروژن به راحتی به نیکل تبدیل می شود و با گرم شدن هوا تبدیل به اکسید نیکل می شود. آب تبلور را از دست می دهد و در دمای بالا بی آب می شود. محلول آبی اسیدی است. نیکل کلراید می تواند با آنیون های بسیاری از مولکولهای معدنی و آلی ترکیب شده و مجتمع های نیکل را تشکیل دهد و رسوبات نامحلول در اسیدهای ضعیف ایجاد کند. چگالی کلرید نیکل (II) بیشتر از آب است.
کلرید نیکل (II) ساختاری مشابه CdCl۲دارد. در این موتیف، هر مرکز Ni۲ + با شش مرکز Cl۲ کووردینات شده و هر کلراید به سه مرکز Ni (II) پیوند داده شده است. در NiCl۲ پیوندهای Ni-Cl “خاصیت یونی” دارند.در مقابل، نیکل کلرید ۶ آبه، متشکل از مولکولهای ترانس [NiCl۲ (H۲O) ۴] جدا شده است که به طور ضعیف تر به مولکولهای آب مجاور متصل می شوند. فقط چهار مولکول از شش آب موجود در فرمول به نیکل متصل است و دو مورد باقی مانده آب تبلور است.
دی هیدرات NiCl2 · ۲H2O ساختاری میانی بین هگزاهیدرات و اشکال بی آب را تایید می کند. این فرم از کلرید نیکل از زنجیره های بی نهایت NiCl۲ تشکیل شده است، که در آن هر دو مرکز کلراید لیگاندهای پل هستند.محلول های کلرید نیکل (II) اسیدی هستند، که این امر به دلیل هیدرولیز یون Ni۲ + ، در حدود pH4است.بیشتر واکنش های منتسب به “کلرید نیکل” شامل نیکل کلرید هگزاهیدرات است، اگرچه واکنش های خاص به شکل بی آب کلرید نیکل نیاز دارند.
واکنش هایی که از NiCl2 · ۶H2O شروع می شوند می توانند برای تشکیل انواع کمپلکس های نیکل مورد استفاده قرار گیرند. زیرا لیگاندهای H۲O به سرعت توسط آمونیاک، آمین ها، تیواترها، تیولات ها و ارگانوفسفین ها جابجا می شوند. در برخی از مشتقات، کلرید در شکل کووردینات باقی می ماند، در حالی که کلرید با لیگاندهای بسیار بازی جابجا می شود.
|
۱۴۰℃ -H{2}O
|
Melting point
|
|
۱,۹۲ g/cm۳
|
Density
|
|
Store at RT.
|
Storage temp
|
|
۲۵۴۰g/l
|
Solubility
|
|
Solution
|
Form
|
|
Green
|
Color
|
|
۴.۹ (۱۰۰g/l, H2O, 20℃)
|
PH
|
|
۲۵۴۰ G/L (20 ºC)
|
Water Solubility
|
|
Hygroscopic
|
Sensitive
|
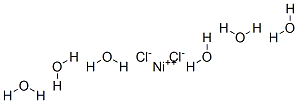 |
Structure |
 |
Chemical Safety |
| Cl۲H۱۲NiO۶ | Molecular Formula |
| (II) chL;Nickel chlorid;NickelChlorideAr;oride hexahydrate;Nichelous Chloride;NICKELOUS CHLORIDE;COULOMETRY REAGENT;NICKEL CHLORIDE 6H2O;NICKEL CHLORIDE , 99.99%;NICKEL CHLORIDE, HYDROUS | Synonyms |
| ۲۳۷.۶۹ | Molecular Weight |
منابع :
https://www.chemicalbook.com/ChemicalProductProperty_EN_CB0116468.htm
https://www.chemicalbook.com/ChemicalProductProperty_EN_CB0396495.htm
https://findanyanswer.com/why-is-nicl2-green
https://pubchem.ncbi.nlm.nih.gov/compound/Nickel-chloride

 شرکت اوج آزما پلاست در سال 1392 در ایران تاسیس گردید. هدف اصلی همکاران ما کوشش در جهت بالابردن سطح سلامت در جامعه جهانی است. شرکت اوج آزما پلاست در زمینه واردات و تولیدات تجهیزات و ملزومات آزمایشگاهی و بیمارستانی فعالیت داشته و از ابتدای شروع فعالیت همواره
شرکت اوج آزما پلاست در سال 1392 در ایران تاسیس گردید. هدف اصلی همکاران ما کوشش در جهت بالابردن سطح سلامت در جامعه جهانی است. شرکت اوج آزما پلاست در زمینه واردات و تولیدات تجهیزات و ملزومات آزمایشگاهی و بیمارستانی فعالیت داشته و از ابتدای شروع فعالیت همواره