
نیترات کلسیم 4 آبه یک نمک بی آب بی رنگ است که در مواردی از جمله به عنوان کود استفاده می شود. نیترات کلسیم با تیمار سنگ آهک با اسید نیتریک ضعیف بدست می آید. همچنین در هنگام جذب اکسید نیتروژن توسط آهک ایجاد می شود. نیترات کلسیم همچنین در تصفیه فاضلاب، به عنوان یک ماده در ساخت بتن، برای اهداف دارویی در حمام های خنک کننده و ذخیره انرژی در نیروگاه های خورشیدی استفاده می شود.
نیترات کلسیم ۴ آبه
نیترات کلسیم ۴ آبه | خرید نیترات کلسیم ۴ آبه | فروش نیترات کلسیم ۴ آبه | قیمت نیترات کلسیم ۴ آبه | خرید | فروش

نیترات کلسیم، که Norgessalpeter (نمکدان نروژی) نیز نامیده می شود، یک ترکیب غیر آلی با فرمول Ca (NO3) ۲ است. این نمک بی رنگ رطوبت هوا را جذب می کند و معمولاً به صورت تترا هیدرات یافت می شود. این ماده به طور عمده به عنوان یک ماده افزودنی در کودها استفاده می شود اما کاربردهای دیگری نیز دارد. نیتروکلسیت نام یک ماده معدنی است که یک نیترات کلسیم هیدراته است و به فرم گل آذین تشکیل می شود. انواع نمک های مرتبط از جمله کلسیم کلرید نیترات آمونیوم دکا هیدرات و نیترات کلسیم پتاسیم دکا هیدرات شناخته شده است.
کود نیترات کلسیم یک محلول شیمیایی محلول در آب است که کلسیم و ازت مکمل را برای گیاهان تأمین می کند. این عناصر عناصر سازنده فیزیولوژیکی گیاهان قوی و مقاوم در برابر بیماری هستند.
نیترات کلسیم در طبیعت یافت نمی شود این ماده با مخلوط کردن کلسیم و نیتروژن غیر آلی ساخته می شود. این کار با ترکیب سنگ آهک و اسید نیتریک و به دنبال آن آمونیاک انجام می شود. کودهای نیترات کلسیم اغلب توسط کشاورزان برای تولید بهتر محصول استفاده می شود. با این حال، این بدان معنا نیست که باغبان خانه نمی تواند یا نباید از نیترات کلسیم برای میوه ها، سبزیجات و گیاهان خانگی خود استفاده کند.
استفاده از نیترات کلسیم به عنوان کود کشاورزی
از کود نیترات کلسیم می توان برای جلوگیری از کمبود کلسیم یا جبران مجدد سطح کلسیم گیاه استفاده کرد. افزایش کلسیم موجود در آن به بهبود قدرت برگ، میوه و ریشه کمک می کند.
کمبود کلسیم در گیاهان کاملاً آسان است. هنگامی که یک گیاه از کمبود کلسیم رنج می برد، رشد جدید آن در حاشیه ظاهری فرفری ایجاد می کند. این رشد جدید همچنین لکه های “کلروتیک” قهوه ای ایجاد می کند. دیگر بافت های گیاهی بزودی شروع به قهوه ای شدن می کنند و این لکه ها سرانجام بزرگ و ادغام می شوند. گیاهان کمبود کلسیم نیز اغلب رگه های برگ قهوه ای تیره دارند.
علاوه بر این، کمبود کلسیم تولید میوه گیاه را با مشکل روبرو می کند. از آنجا که کلسیم دیواره های سلولی قوی ایجاد می کند، یک ماده اساسی برای میوه های بزرگتر است که تقسیم نمی شود.نیترات کلسیم برای بهبود تولید انرژی، دوز نیتروژن قابل استفاده به گیاه می دهد.کمبود نیتروژن، مانند کمبود کلسیم، اگر به موقع درمان نشود، می تواند برای گیاهان نیز کشنده باشد. به همین دلیل نیتروژن یکی از متداول ترین و فراوانترین مواد تشکیل دهنده کودها است.
آیا نیترات کلسیم باعث کاهش PH می شود؟
به طور کلی، خطر قلیایی شدن خاک در اثر استفاده معمول از نیترات کلسیم کم است.اگر از مقدار کود توصیه شده استفاده می کنید یا نسبت موجود در بسته بندی محصول خود را رعایت می کنید، باید از خطر استفاده بیش از حد خود جلوگیری کنید. همزمان با افزایش PH خاک، نیترات کلسیم به گیاه اجازه می دهد مواد مغذی بیشتری جذب کند، که می تواند در طولانی مدت خاک را متعادل کند.
چگونه کلسیم و نیتروژن روی گیاهان تأثیر می گذارد؟
کلسیم مقاومت ساختاری را در دیواره سلول های گیاهان فراهم می کند. این عنصر همچنین برای کمک به ترمیم گیاهان هنگام آسیب دیدگی یا استرس وارد بدن می شود. سیستم عروقی گیاه، کلسیم را به منطقه آسیب دیده فشار می دهد تا آن را تقویت کرده و آسیب ها را ترمیم کند.نیتروژن یک عنصر حیاتی برای فتوسنتز و اسیدهای آمینه گیاهان است. بدون ازت، گیاهان نمی توانند نور خورشید را به عنوان قند برای رشد فرآوری کنند.
-
روش تولید نیترات کلسیم
Norgessalpeter در نوتدن، نروژ در سال ۱۹۰۵ توسط فرآیند Birkeland – Eyde سنتز شد. اکنون بیشتر نیترات کلسیم در جهان در پورسگرون ساخته می شود.
این ماده با تصفیه سنگ آهک با اسید نیتریک و به دنبال آن خنثی سازی با آمونیاک تولید می شود:
CaCO3 + 2 HNO3 → Ca (NO۳) ۲ + CO۲ + H۲O
نیترات کلسیم همچنین یک محصول حد واسط از فرآیند Odda است:
Ca۵(PO۴) ۳OH + 10 HNO۳ → ۳ H۳PO۴ + ۵ Ca(NO۳) ۲ + H۲O
نیترات کلسیم را همچنین می توان از محلول آبی نیترات آمونیوم و هیدروکسید کلسیم تهیه کرد:
۲ NH۴NO۳ + Ca (OH)۲ → Ca (NO۳) ۲ + ۲ NH۴OH
مانند نیترات های فلزات قلیایی مرتبط، نیترات کلسیم هنگام گرم شدن تجزیه می شود (با شروع از ۵۰۰ درجه سانتیگراد) و دی اکسید نیتروژن آزاد می کند:
۲ Ca (NO۳)۲ → ۲ CaO + 4NO۲ + O۲ ΔH = 369 kJ / mol
نیترات کلسیم ۴آبه
نیترات کلسیم تترا هیدرات فرم چهار آبه نمک کلسیم و یک نمک نیترات غیر آلی است.
کاربرد های نیترات کلسیم ۴ آبه
استفاده در کشاورزی
از نیترات کلسیم برای کنترل برخی بیماری های گیاهی نیز استفاده می شود. به عنوان مثال، از اسپری های نیترات کلسیم رقیق (و کلرید کلسیم) برای کنترل گودال تلخ و لکه چوب پنبه در درختان سیب استفاده می شود.ازنیترات کلسیم در پیش تصفیه فاضلاب برای جلوگیری از انتشار بو استفاده می شود. در حضور نیترات، متابولیسم سولفات ها متوقف می شود، بنابراین از تشکیل سولفید هیدروژن جلوگیری می کند. علاوه بر این مواد آلی تجزیه پذیر آسان مصرف می شود، که در غیر این صورت می تواند باعث شرایط بی هوازی در پایین دست و همچنین انتشار بو شود. این مفهوم برای تصفیه لجن مازاد نیز کاربرد دارد.
ازنیترات کلسیم در مواد افزودنی بتن تسریع شونده استفاده می شود. یون کلسیم تشکیل هیدروکسید کلسیم را تسریع می کند و در نتیجه رسوب می کند. این ترکیب همچنین در بتن ریزی در هوای سرد و همچنین برخی از نرم کننده های ترکیبی استفاده می شود. یون نیترات منجر به تشکیل هیدروکسید آهن می شود که لایه محافظ آن باعث کاهش خوردگی آرماتور بتن می شود.
منعقد کننده لاتکس
نیترات کلسیم یک ماده منعقد کننده بسیار رایج در تولید لاتکس، به ویژه در فرآیندهای غوطه وری است. نیترات کلسیم محلول بخشی از محلول غوطه وری است. ماده اولیه گرم به مایع انعقاد فرو رفته و یک لایه نازک از مایع غوطه وری روی ماده قبلی باقی می ماند. نیترات کلسیم هنگام غوطه وری اولین مورد در لاتکس ، باعث تثبیت محلول لاتکس می شود و لاتکس روی ماده قبلی لخته می شود.
بسته های سرد
انحلال تترا هیدرات نیترات کلسیم بسیار گرمازا است (خنک کننده). به همین دلیل ، نیترات کلسیم تتراهیدرات گاهی اوقات برای بسته های قابل بازیافت سرما استفاده می شود.
نمک های مذاب برای انتقال و ذخیره گرما
نیترات کلسیم می تواند به عنوان بخشی از مخلوط نمک مذاب استفاده شود. مخلوط های دوتایی نیترات کلسیم و نیترات پتاسیم یا مخلوط سه تایی از جمله نیترات سدیم به طور معمول است. از این نمک های مذاب می توان برای جایگزینی روغن ترمور در نیروگاههای خورشیدی غلیظ برای انتقال گرما استفاده کرد، اما بیشتر آنها در ذخیره گرما استفاده می شوند.از نیترات کلسیم تتراهیدرات در تهیه محلول های استاندارد کلسیم نیز استفاده می شود.
خصوصیات فیزیکی و شیمیایی نیترات کلسیم
نیترات کلسیم چهار آبه کریستالهای سفید و یا بی رنگ هستند.
|
۴۴ °C (dec.)(lit.)
|
Melting point |
|
۱۳۲ °C
|
Boiling point
|
|
۱.۸۶
|
Density
|
|
۱۳۲°C
|
Flash point
|
|
Store at RT.
|
storage temp.
|
|
H۲O: 1 M at ۲۰ °C, clear, colorless
|
solubility
|
|
Solid
|
form
|
|
۱.۸۶
|
Specific Gravity
|
|
White
|
color
|
|
۵.۰-۷.۰ (۵۰g/l, H2O, 25℃)
|
PH
|
|
۱۴۷۰ g/L (0 ºC)
|
Water Solubility
|
|
Hygroscopic
|
Sensitive
|
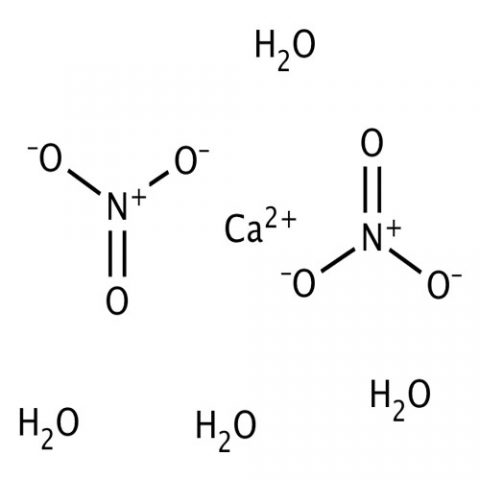
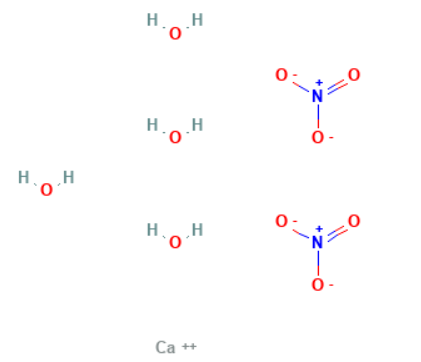 |
Structure |
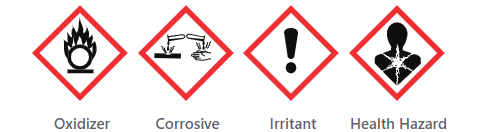 |
Chemical Safety |
| Ca(NO۳)۲·۴H۲O or CaH۸N۲O۱۰ | Molecular Formula |
|
Calcium nitrate tetrahydrate ۱۳۴۷۷-۳۴-۴ MFCD00149604 calcium;dinitrate;tetrahydrate Calcium nitrate tetrahydrate, 98%, extra pure
|
Synonyms |
| ۲۳۶.۱۵ g/mol | Molecular Weight |
منابع :
https://www.trees.com/gardening-and-landscaping/calcium-nitrate-fertilizer
https://pubchem.ncbi.nlm.nih.gov/compound/Calcium-nitrate-tetrahydrate
https://www.ebi.ac.uk/chebi/searchId.do?chebiId=CHEBI:86159
https://thechemco.com/chemical/calcium-nitrate/
https://www.chemicalbook.com/ChemicalProductProperty_EN_CB0204697.htm
 شرکت اوج آزما پلاست در سال 1392 در ایران تاسیس گردید. هدف اصلی همکاران ما کوشش در جهت بالابردن سطح سلامت در جامعه جهانی است. شرکت اوج آزما پلاست در زمینه واردات و تولیدات تجهیزات و ملزومات آزمایشگاهی و بیمارستانی فعالیت داشته و از ابتدای شروع فعالیت همواره
شرکت اوج آزما پلاست در سال 1392 در ایران تاسیس گردید. هدف اصلی همکاران ما کوشش در جهت بالابردن سطح سلامت در جامعه جهانی است. شرکت اوج آزما پلاست در زمینه واردات و تولیدات تجهیزات و ملزومات آزمایشگاهی و بیمارستانی فعالیت داشته و از ابتدای شروع فعالیت همواره